La hernie diaphragmatique congénitale (HDC) est une malformation génétique grave et sévère qui correspond à une anomalie de développement du diaphragme. Elle provoque une hernie des viscères abdominaux dans le thorax. Cela empêche le développement pulmonaire normal in utéro. Cette maladie touche 1 naissance sur 3500, soit 50 000 naissances par an dans le monde. Les chercheurs de l’INSERM (Unité 1121 – Biomatériaux et Bioingénierie), de l’ICS et les ingénieurs du Cetim Grand Est, tous membres de MICA, et en étroite collaboration avec la chirurgienne infantile Isabelle Talon, ont mis au point un matériau élastique qui suivrait la croissance de l’enfant. Ce matériau pourrait à terme révolutionner l’implant qui sert à refermer le diaphragme.
Le traitement actuel d’un nouveau-né atteint d’une HDC consiste aujourd’hui dans la résorption de la hernie viscérale et la pose d’une prothèse en polytétrafluoroéthylène (PTFE). L’objectif est de refermer le diaphragme et ainsi éviter toute remontée des viscères. Mais ce matériau n’est pas élastique et entraîne à terme des anomalies dans la croissance, voire un décrochement de l’implant provoquant une nouvelle hernie. A travers le projet de ressourcement DIAART, financé par l’Institut Carnot MICA, les chercheurs ont imaginé la mise au point d’un matériau élastique, biocompatible, qui permettrait à l’implant de suivre la croissance de l’enfant.

Développement d’une méthode pour générer des matériaux poreux en polyuréthane avec une architecture contrôlée. L’objectif est d’étudier l’influence de la structure sur la capacité de plusieurs types de cellules à coloniser le matériau. Sur cette figure, des sphères de paraffine avec une distribution en taille rationalisée sont compactées, chauffées, puis recouvertes de polyuréthane (images du haut). Après la dissolution des sphères (images du bas), il est possible d’obtenir un matériau possédant à la fois une porosité, et une taille des passages (ou interconnexions) entre chaque pore (r) maîtrisée. Cette approche a premise de réaliser des systemes modèles pour étudier leur influence sur le comportement cellulaire.
Dès le démarrage du projet, les chercheurs ont identifié trois verrous à lever : le matériau à créer devait être biocompatible, élastique pour suivre la croissance de l’enfant et poreux pour permettre une colonisation par des cellules musculaires striées similaires à celles du diaphragme, pour le rendre lisse empêchant toute adhésion des viscères à ce dernier. Pour répondre à ces challenges, les équipes ont choisi de développer un film à base de polyuréthane, matériau approuvé cliniquement et déjà connu pour ses propriétés de biocompatibilité et d’élasticité.
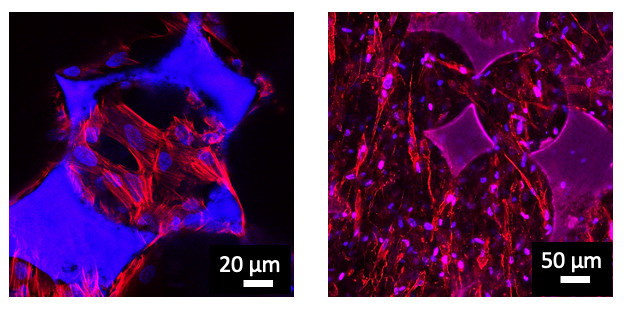
Étude de la colonisation cellulaire au sein des matériaux poreux. Les deux images correspondent à des matériaux pour lesquels les diamètres des pores et des interconnexions étaient optimisés pour permettre une colonisation quasi-totale des cellules. Deux types de cellules différentes ont été ensemencées dans ces structures: des cellules souches mésenchymateuses (image de gauche), et des fibroblastes (image de droite). Ceci démontre la polyvalence de ces systèmes pour des applications en ingénierie tissulaire.
Les deux premiers verrous étaient levés, il restait à mettre au point une technique permettant de donner au matériau la porosité nécessaire à la colonisation biologique. Pour se faire, les chercheurs ont l’idée d’utiliser des billes en paraffine sacrificiels dont ils contrôleraient la taille et leurs interconnexions, pour avoir des propriétés physiques permettant une colonisation idéale de cellules biologiques. Une fois le « lit » créé, ils le recouvrent de polyuréthane, le polymérisent et le passent dans du solvant pour dissoudre les billes et récupérer ensuite le film. Un traitement plasma et PDA est ensuite effectué pour supprimer la propriété hydrophobe du matériau qui empêcherait la colonisation des cellules contenues dans leur fluide biologique.
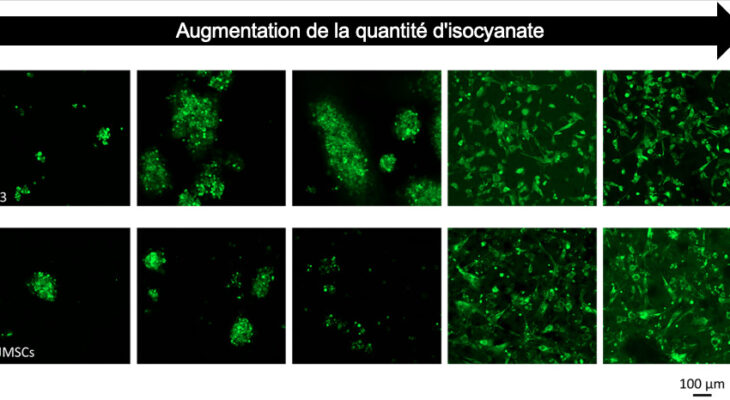
Le film était créé, les chercheurs pouvaient à présent l’étudier pour l’optimiser et trouver la meilleure composition pour en faire une prothèse efficace. Ils ont découvert que l’indice de l’isocyanate avait une influence importante sur l’adhésion des cellules, du fait de la microstructure de cette molécule. Plus l’indice est haut, plus les cellules adhèrent à la prothèse. D’autres traitements ont été appliqués au film pour accélérer l’adhésion cellulaire, comme l’injection d’albumine, une protéine naturelle peu onéreuse.
Aujourd’hui, les chercheurs ont validé, grâce à l’ensemble des travaux réalisés et par l’analyse physico-chimique complète de la prothèse nouvellement créée, la composition idéale pour répondre à la problématique posée par cette malformation du diaphragme, ouvrant la voie aux développements d’autres prothèses nécessitant des caractéristiques similaires. Une problématique restante encore : la non résistance du matériau aux points de sutures. Cette problématique est aujourd’hui l’objet d’un nouveau projet de recherche, lancé entre l’unité INSERM et l’Institut de chimie et procédés pour l’énergie, l’environnement et la santé (ICPEES) de Strasbourg. Le but : créer le matériau par spin-coating, une technique de formation d’une couche mince et uniforme, par dépôt d’une solution de la substance du film, sur la surface plane d’un substrat qui tourne à vitesse élevée.
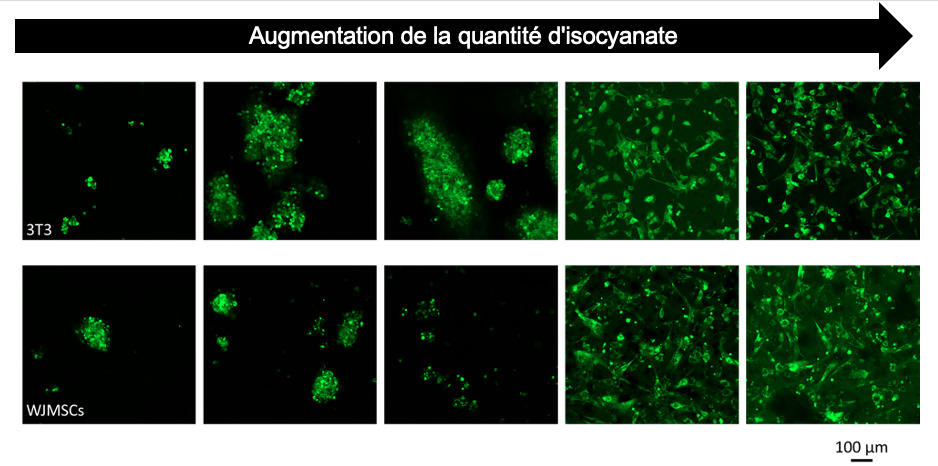
Contrôle de l’adhésion de fibroblastes (3T3, images du haut), et de cellules souches mésenchymateuse (WJMSCs, images du bas) sur du polyuréthane, en fonction de la quantité d’isocyanate utilisé lors de la synthèse. Nous avons pu voir apparaître une valeur seuil au-delà de laquelle l’adhésion des cellules était totale. Des analyses de diffusion des rayons X, ont notamment permises de corréler ces observations à la microstructure du polymère, révélant la présence d’une séparation de phase formant des ilots qui pourraient permettre l’adhésion des cellules.